
Grundlagen zu Latexbindemitteln: Polymerstabilisierung
Chemiker beschreiben Latex bisweilen als kolloidal stabile Dispersion, d. h. die Teilchen, aus denen die Dispersion besteht, entmischen sich mit der Zeit nicht. Dies wird durch eine Kombination aus ionischer und sterischer Stabilisierung erreicht...
Chemiker beschreiben Latex bisweilen als kolloidal stabile Dispersion, d. h. die Teilchen, aus denen die Dispersion besteht, entmischen sich mit der Zeit nicht. Dies wird durch eine Kombination aus ionischer und sterischer Stabilisierung erreicht. Lesen Sie weiter, um sich über die Funktionsweise dieser zwei einzigartigen Mechanismen zu informieren.
Das Wort „Latex“ hat seinen Ursprung im Lateinischen und bedeutet wörtlich „Flüssigkeit“. Im frühen 19. Jahrhundert, in dem das Wort in den Sprachgebrauch übernommen wurde, bezeichnete Latex eine spezielle Flüssigkeit – den milchig weißen Saft des Kautschukbaums und anderer ähnlicher Pflanzenarten. Der Latex ist eine Milch – ein in Wasser dispergiertes Protein.
Heute bezeichnet Latex sowohl den natürlich vorkommenden Typ als auch synthetische Typen, die durch ein Verfahren hergestellt werden, das als Polymerisation bezeichnet wird. Gleichzeitig definieren Wissenschaftler Latex präziser als kolloidale Dispersion. Synthetischer Latex besteht zumeist aus in Wasser dispergierten Polymerteilchen, in der Regel mit einem Durchmesser von wenigen hundert Nanometern. Die Dispersion insgesamt wird als kolloidal stabil beschrieben, damit ist sie lagerfähig, ohne dass die Teilchen, aus denen die Dispersion besteht, sich mit der Zeit entmischen.
Um zu verstehen, warum sich Latex so verhält, müssen wir genauer untersuchen, was „kolloidal stabil“ bedeutet. Was ist ein Kolloid? Was ist Stabilisierung, und wie trägt sie zu dem Herstellungsprozess der Latexprodukte bei, denen wir täglich begegnen, wie z. B. Farben, Klebstoffen und Bindemitteln?
Ein Crashkurs zu Kolloiden
Ein Kolloid ist eine Art Mischung aus zwei Phasen – einer kontinuierlichen Phase (das Dispersionsmedium) und einer dispergierten Phase (die Teilchen). Die Teilchengröße der dispergierten Phase befindet sich typischerweise in einem Bereich von 1 Nanometer (1 milliardstel Meter oder der Abstand von der Mitte eines Sauerstoffatoms zu einem Wasserstoffatom in Wasser) bis 1 Mikrometer, wobei Latexteilchen zwischen 100 und 300 Nanometern liegen. Es gibt verschiedene Arten von kolloidalen Dispersionen:
- ein Feststoff, der in einer Flüssigkeit verteilt ist, auch Suspension, Dispersion oder Emulsion genannt,
- eine Flüssigkeit, die in einer anderen Flüssigkeit verteilt ist,
- ein Gas, das in einer Flüssigkeit verteilt ist,
- eine Flüssigkeit, die in einem Gas verteilt ist,
- ein Feststoff, der in einem Gas verteilt ist.
Bei allen diesen Dispersionen sind die Kolloidteilchen nicht stationär. Sie bewegen sich nach einem zufälligen Muster, der so genannten Brownschen Bewegung. Während sie sich umherbewegen, können sie zusammenstoßen, und diese Zusammenstöße können zu einer Agglomeration und letztendlich zu einer Koagulation führen – Teilchen, die aufgrund der relativ schwachen elektrischen Anziehung aneinander haften, die über Van-der-Waals-Kräfte auftritt. Wenn die Teilchen koagulieren, kann das Kolloid instabil werden, was ein unerwünschtes Ergebnis darstellt. Wie begegnen Chemiker daher der Van-der-Waals-Anziehung?
Es gibt zwei hauptsächliche Ansätze zum Verhindern der Koagulation, die wir im Folgenden betrachten.
Elektrostatische Stabilität
Die Stärke dieser Abstoßung hängt von zwei Variablen ab – der Ladungsdichte an den Teilchenoberflächen und dem umgebenden Medium. Beispielsweise kann durch Zusatz eines Elektrolyts (wie z. B. Salz) die elektrostatische Abstoßung verringert werden, sodass die Van-der-Waals-Anziehung wieder die Oberhand gewinnen und die Kolloidteilchen zueinander hinziehen kann. Letztlich kann dies dazu führen, dass die Dispersion instabil wird. Bei negativ geladenen Teilchen wird dieser Effekt besonders verstärkt, wenn dem Medium Elektrolyte mit mehrwertigen Kationen, wie z. B. Ca+2, Al+3 und Fe+3, hinzugefügt werden.
Chemiker stützen sich als Indikator der elektrostatischen Stabilisierung auf einen Umstand, der Zeta-Potential genannt wird. Die Größe des Zeta-Potentials ist direkt proportional zum Grad der elektrostatischen Abstoßung zwischen angrenzenden, ähnlich geladenen Teilchen in einer Dispersion. Bei Molekülen und Teilchen, die klein genug sind, ist ein hohes Zeta-Potential ein zuverlässiger Marker der kolloidalen Stabilität. Ein niedriges Zeta-Potential deutet im Allgemeinen auf Instabilität und eine höhere Gefahr der Koagulation hin.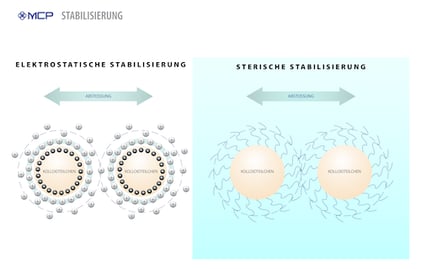
Sterische Stabilisierung
Die zweite Möglichkeit zur Bekämpfung der Koagulation ist mit einem Mechanismus verbunden, der sterische Stabilisierung genannt wird. „Sterisch“ ist ein Begriff, der die Anordnung der Atome im dreidimensionalen Raum beschreibt, ähnlich dem Konzept der Räumlichkeit. Bei kolloidalen Dispersionen bezieht sich die sterische Stabilisierung darauf, dass die Oberfläche von Kolloidteilchen derart modifiziert wird, dass diese mit schleifenartigen Molekülstrukturen in die kontinuierliche Phase über dem Teilchen hineinragen. Dieses Hineinragen verhindert auf physische Weise, dass sich zwei Teilchen einander annähern.
Chemiker führen die sterische Stabilisierung herbei, indem sie dem Medium verschiedene Inhaltsstoffe hinzufügen, die die Kolloidteilchen überlagern bzw. bedecken. Zu diesen Inhaltsstoffen gehören eine Reihe von chemischen Stoffen, jedoch werden im Allgemeinen nichtionische Tenside mit hydrophilen Ketten verwendet. Diese Additive haften an den Teilchen und bilden eine Adsorbtionsschicht mit einer bestimmten Stärke. Wenn sich zwei Teilchen weit genug einander annähern, können die Adsorbtionsschichten überlappen oder zusammengedrückt werden, wodurch eine starke Abstoßungskraft entsteht. Diese Abstoßung ist es, die Teilchen auseinander treibt und Stabilität fördert.
Bisweilen bleiben die stabilisierenden Moleküle unverankert und befinden sich zwischen Kolloidteilchen. Sogar in dieser Konfiguration schützen sie weiterhin vor der Annäherung von Teilchen und verhindern somit die Koagulation.
Ionisch vs. sterisch
Stabilität ist ein wichtiges Konzept bei der Herstellung und Verwendung von Latex. Es handelt sich um ein empfindliches Gleichgewicht von anziehenden und abstoßenden Kräften. Die Art, in der Chemiker die Stabilisierung erzielen, ist ein wichtiges Werkzeug in ihrem Werkzeugkasten. Die Stabilität wirkt sich auf die Eigenschaften des Latex aus. Übermäßige ionische oder sterische Stabilität kann Haftung, Füllstoffaufnahme oder Filmbildung verhindern. Zu geringe ionische oder sterische Stabilität kann dazu führen, dass der Latex die Dispersion nicht bis zum Zeitpunkt der Anwendung aufrechterhält. In der nachstehenden Tabelle sind einige der wichtigsten Unterschiede zwischen anionischer und sterischer Stabilisierung zusammengefasst:
|
Merkmal |
Ionische Stabilisierung |
Sterische Stabilisierung |
|
Von elektrostatischer Ladung hervorgerufen |
Ja |
Nein |
|
Auswirkungen einer Verdünnung |
Keine, wenn die Ladung kovalent an das Polymer gebunden ist |
Bei hohen Latexverdünnungen kann eine Destabilisierung auftreten |
|
Auswirkung kationischer (positiv geladener) Spezies |
Wird durch kationische Spezies destabilisiert |
Unempfindlich gegenüber Kationen |
|
Auswirkungen des pH-Werts |
Höhere Stabilität bei höherem pH-Wert |
Unempfindlich gegenüber Latex-pH-Wert, außer wenn stabilisierendes Tensid pH-empfindlich ist |
Das Team bei Mallard Creek Polymers hilft Ihnen beim Verständnis aller Aspekte der Latexherstellung, einschließlich der Stabilisierung. Wir analysieren gemeinsam mit Ihrem Team die speziellen Anforderungen Ihrer Anwendung und legen dann ein chemisches Programm fest, mit dem sich ein fertiges Produkt ergibt, das diesen Anforderungen entspricht. Rufen Sie uns heute noch an, um Ihr nächstes Projekt zu besprechen.
Lesen Sie auch unsere anderen Artikel unserer Reihe Grundlagen zu Latex:

 Construction
Construction
 Nonwovens
Nonwovens
 Adhesives
Adhesives
 Textiles
Textiles
 Printing & Packaging
Printing & Packaging
 Paper
Paper
 Paints & Coatings
Paints & Coatings





